D-胱氨酸是一种重要的氨基酸,具有多种生物学功能和药理作用。天冬氨酸-半醛脱氢酶是一种关键的酶,在生物体内参与氨基酸代谢和氧化还原反应。有研究表明,D-胱氨酸可能对天冬氨酸-半醛脱氢酶具有一定的抑制作用。
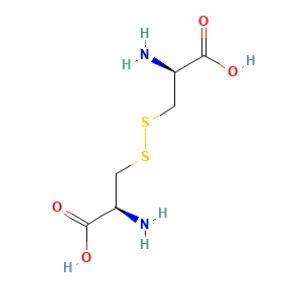
简介:D-胱氨酸是一种天然产物,存在于甘氨酸、羊肚菌和其他生物中。D-胱氨酸是胱氨酸的D-对映体。是L-胱氨酸的一种对映体,是D-胱氨酸两性离子的一种互变异构体。其是一种由半胱氨酸氧化形成的共价连接的二聚非必需氨基酸。两个半胱氨酸分子通过二硫键连接在一起形成胱氨酸。D-胱氨酸的结构如下图所示:
应用:天冬氨酸-半醛脱氢酶抑制剂
D-胱氨酸对大肠杆菌中l -天冬氨酸-β-半醛脱氢酶(ASADH)有抑制作用。
(1)l-天冬氨酸-β-半醛脱氢酶简介
l-天冬氨酸-β-半醛脱氢酶(ASADH;E.C.1.2.1.11)是一种由相同亚单位组成的二聚酶。在生物合成方向上,ASADH利用NADPH催化l-β-天冬氨酸-磷酸还原去磷酸化形成l-天冬氨酸-β-半醛(ASA)。ASADH反应与甘油醛-3-磷酸脱氢酶催化的反应有关。半胱氨酸硫代盐攻击底物羰基形成硫酯中间体,随后氢化物转移到NADP。随后通过结合的无机磷酸盐的氧阴离子攻击硫酯中间体导致半胱氨酸硫代盐的排出和磷酸化产物的形成。用ASA进行的针对n -乙基马来酰亚胺失活的底物保护研究表明,必需的半胱氨酸位于酶活性位点内或附近。此外,pH研究表明,中性酸基必须电离才能发挥酶活性。对于这一基团确定的pKa值与当被n -乙基马来酰亚胺修饰时导致酶活性丧失的酶基的pKa值相似。用l-2-氨基-4-氧代-5-氯戊酸亲和标记法研究了大肠杆菌来源的天冬氨酸半醛脱氢酶的底物结合位点。底物类似物以伪一级动力学和半位点反应性不可逆地使酶失活。天冬氨酸半醛底物保护酶不被灭活。活性位点上标记了一个基团,并确定为组氨酸残基的侧链。
(2)相关研究
来自大肠杆菌的天冬氨酸-β-半醛脱氢酶(ASADH)可被l-胱氨酸和d-胱氨酸以及其他胱氨酸衍生物抑制。Emilio Alvarez等人在胱氨酸灭活的酶中加入二硫苏糖醇(DTT),二硫红糖醇,β-巯基乙醇,二巯基丙醇或谷胱甘肽,可以定量逆转酶抑制。这种酶的胱氨酸标记是一个pH依赖性过程,在pH值从7.0到7.5范围内最优。半胱氨酸掺入谱和酶随pH变化的失活曲线表明,pKa为8.5的基团可能参与了半胱氨酸的结合。失活反应的化学计量表明,该酶亚单位的一个半胱氨酸残基与胱氨酸反应,如将放射性胱氨酸直接掺入酶中,以及在胱氨酸处理前后用5,5 ' -二硫代二硝基苯甲酸(DTNB)对酶进行游离巯基滴定所发现的。每摩尔胱氨酸与该酶反应后释放1mol半胱氨酸。ASA、NADP和NADPH不能阻止胱氨酸的抑制作用。[35S]半胱氨酸标记的酶可以在聚丙烯酰胺凝胶电泳后显影,并通过放射自显影术进一步检测。胃蛋白酶处理[35S]半胱氨酸灭活酶后,通过HPLC分离出主要的放射性肽。该肽的氨基酸序列确定为FVGGN(Cys)2TVSL,从而证明必需的135Cys是经胱氨酸处理后的氨基酸残基。
有研究报道,D-胱氨酸在0.01mM时抑制70%,通过半胱氨酸部分与酶的催化Cys135共价结合,pH依赖性过程,在pH 7.0-7.5时最佳,DTT,二硫代赤藓糖醇,2-巯基乙醇,二巯基丙醇和还原型谷胱甘肽可逆抑制,不受天冬氨酸-β-半醛,NADP +或NADPH的保护,
参考:
[1]https://pubchem.ncbi.nlm.nih.gov/compound/6857538
[2]https://www.brenda-enzymes.org/all_enzymes.php?ecno=1.2.1.11&table=Inhibitors
[3]Alvarez E, Ramón F, Magán C, et al. l-Cystine inhibits aspartate-β-semialdehyde dehydrogenase by covalently binding to the essential 135Cys of the enzyme[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2004, 1696(1): 23-29.

