使用同位素示踪法研究酯化反应中的脱水方式。通过使用含有示踪原子的CH3CH218OH与CH3COOH反应,并测定产物中的示踪原子含量,可以得出酯化反应的脱水方式是“酸脱羟基醇脱氢”。

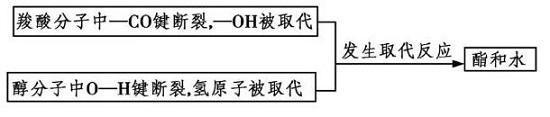
化学方程式:
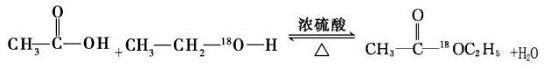

(1) 加热:主要目的是提高反应速率,使乙酸乙酯挥发便于收集,同时促使平衡向正反应方向移动,提高乙醇和乙酸的转化率。
(2) 浓硫酸:一方面作为催化剂提高反应速率,另一方面作为吸水剂提高乙醇和乙酸的转化率。
(3) 饱和Na2CO3溶液的作用:
① 挥发的乙酸与Na2CO3反应生成易溶于水的盐,乙醇易溶于Na2CO3溶液,有利于乙酸乙酯与乙酸、乙醇的分离。
② 乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,与饱和Na2CO3溶液混合时易分层,可用分液法分离。
在试管中加入3 mL乙醇,然后缓慢加入2 mL浓硫酸和2 mL冰醋酸,边摇动试管。按照图示连接实验装置。使用酒精灯小心均匀地加热试管3~5分钟,产生的蒸气通过导管通到饱和碳酸钠溶液的液面上。
饱和碳酸钠溶液的液面上会产生无色透明的油状液体,并且可以闻到香味。
在有浓硫酸存在且加热的条件下,乙酸与乙醇发生反应,生成无色、透明、微溶于水、有香味的油状液体。
(1) 浓硫酸的作用:催化剂和吸水剂。
(2) 为防止试管中液体在实验时暴沸,加热前应采取的措施:在试管中加入几块碎瓷片或沸石。
(3) 不要将玻璃导管的末端插入饱和Na2CO3溶液中,以防液体倒吸。
(4) 开始时要用小火均匀加热,加快反应速率,减少乙醇和乙酸的挥发;待有大量产物生成时,可使用大火加热,以便将产物蒸出。
(5) 装置中的长导管起到导气和冷凝的作用。
(6) 欲提高乙酸的转化率,可以采取以下措施:
① 使用浓H2SO4吸水,使平衡向正反应方向移动;
② 加热将酯蒸出;
③ 可适当增加乙醇的量,并加装冷凝回流装置。由于浓硫酸溶于乙醇或乙酸时会放出大量热量,因此一般先加入乙醇,然后边摇动试管边缓慢加入浓硫酸,最后加入冰醋酸。

