引言:
盐酸与亚硫酸钠反应会产生氯化钠和二氧化硫气体。这一反应通常在实验室中用于制备二氧化硫气体。
亚硫酸钠简介:
亚硫酸钠是一种无机盐,化学式为 Na2SO3。它是一种离子化合物,含有两个钠阳离子 (Na+) 和一个亚硫酸根阴离子 (SO32-)。亚硫酸钠在水中的饱和溶液呈弱碱性,pH 值约为 9。
亚硫酸钠 (Na2SO3) 是一种白色、水溶性、结晶固体,具有硫磺味和咸味。加热时会分解。它通常以粉末、结晶和片剂形式提供。亚硫酸钠是公用事业广泛使用的另一种脱氯剂。亚硫酸钠性质略带碱性。亚硫酸钠是一种还原剂,据报道比硫代硫酸钠能清除更多的氧气。食品工业使用亚硫酸钠来帮助保持食品的新鲜外观。在许多药物中,它也是一种有助于保持其效力和稳定性的元素。亚硫酸钠已被 FDA 批准为一种新的低监管优先级动物药物。
1. 亚硫酸钠的化学成分和性质
亚硫酸钠
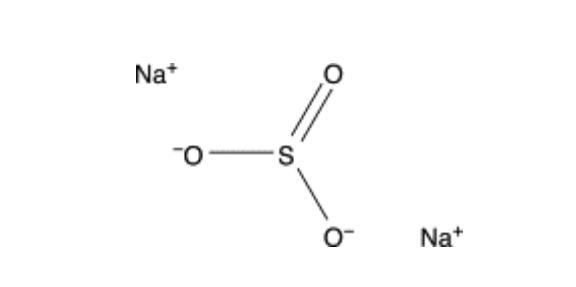
其他名称:无水亚硫酸钠、Natrii sulfis (EP)、亚硫酸二钠盐
INCI:亚硫酸钠
CAS 编号:7757-83-7
分子式:Na2SO3
分子量:126.04
预期功能:抗氧化剂、卷发/拉直剂、还原剂
Log P:?3.72
致癌潜力:第 3 类(谨慎使用)
致敏潜力:弱致敏剂(最大剂量 = 7.29 μg/cm2/小时)
2. 用途
虽然其主要应用在纸浆和造纸工业,但 Na2SO3 还有许多其他应用。
(1)这种化合物通常用于防止干果变色,因为它可以充当防腐剂。
(2)它还用于游泳池以降低水中的氯含量。
(3)在锅炉系统中,这种化合物充当除氧剂,以保护系统免受点蚀。因此,锅炉中的水通常用亚硫酸钠处理。
(4)纺织工业广泛使用 Na2SO3 进行漂白、脱氯和脱硫。
(5)亚硫酸钠还用于净化三硝基甲苯 (TNT) 的过程,以使其适合军事用途。
(6)这种化合物也是制备硫代硫酸钠的重要组成部分。
3. 盐酸的性质及其与亚硫酸钠的相互作用
3.1 盐酸的酸性
盐酸 (HCl) 是一种强酸。这意味着它很容易在水中释放氢离子 (H+)。强酸在水中完全解离,这意味着几乎所有的 HCl 分子都会分离成 H+ 和氯离子 (Cl-)。
酸度以 pH 值来衡量,范围从 0(非常酸性)到 14(非常碱性)。pH 值为 7 被认为是中性的。pH 值越低,氢离子浓度越高,酸性越强。HCl 是一种强还原性酸,与大多数材料接触时具有很强的腐蚀性。HCl 是单质子的,这意味着它在水中具有很高的解离度,这会导致溶液中 H+ 离子过多。H+ 离子过多意味着它的 pH 值非常低,为 0-1。
3.2 HCl与亚硫酸钠反应会发生什么?
亚硫酸钠与稀盐酸之间的化学反应以析出二氧化硫气体为特征。当亚硫酸钠在实验室中与稀盐酸发生反应时,会形成氯化钠盐、水并释放二氧化硫气体。稀盐酸与亚硫酸钠反应的平衡方程式如下:
Na2SO3 + 2HCl→2NaCl + H2O + SO2
其中 Na2SO3是亚硫酸钠,HCl是盐酸,NaCl是氯化钠,H2O是水,SO2是二氧化硫。
反应产物释放的硫气体具有明显的金属燃烧气味。这意味着可以通过二氧化硫气体特有的气味轻松观察到产物的形成。稀盐酸和亚硫酸钠之间的反应导致三氧化硫从其化合物中置换出来形成二氧化硫。类似地,氢被盐酸取代形成水。
在反应中,两种反应物都发生置换,产生更新的产物。由于上述反应之前原子从其化合物中置换出来形成新化合物,因此该反应称为双置换反应。因此,我们看到稀盐酸和亚硫酸钠之间的反应是一种双置换反应,这将导致氯化钠、水和二氧化硫气体的形成。
4. 亚硫酸钠与盐酸的用途和应用
盐酸 (HCl) 和亚硫酸钠 (Na2SO3) 之间的反应有一个主要应用:
实验室制备二氧化硫 (SO2):稀盐酸与亚硫酸钠之间的反应是制备二氧化硫的实验室方法之一。
SO2 是一种无色气体,具有刺激性气味,用于各种应用,例如:
食品防腐剂:在低浓度下,SO2 可作为抗菌剂,防止干果、葡萄酒和其他食品变质。
漂白剂:SO2 在纸浆和造纸工业中用于漂白木浆。
熏蒸剂:在某些情况下,SO2 用作熏蒸剂来消灭储存的谷物和其他产品中的害虫。
5. 亚硫酸钠与盐酸的反应和使用对环境的影响
二氧化硫气体在水中高度可溶,形成一种称为硫酸的强酸。大气中的二氧化硫气体与水蒸气结合,成为酸雨的原因之一。此外,反应过程中产生的氯化钠会增加水体的盐度,对水生生物造成危害。
为了减少亚硫酸钠与盐酸反应对环境的影响,可以采取以下措施:
采用清洁生产工艺,减少二氧化硫的排放。
加强对废水和废气的处理,降低污染物排放量。
合理使用亚硫酸钠,避免过度使用。
6. 亚硫酸钠与盐酸的反应预防措施和安全注意事项
6.1 预防措施
为了防止亚硫酸钠与盐酸反应过程中发生意外,应采取以下预防措施:
操作人员应接受专业培训,熟悉反应的原理、条件和操作方法。
操作人员应佩戴必要的防护装备,包括防护眼镜、手套、口罩等。
反应应在通风良好的地方进行。
反应结束后,应及时清理反应残留物,并妥善处理。
应定期检查反应设备,确保其处于良好状态。
6.2 安全注意事项
在进行亚硫酸钠与盐酸反应时,应注意以下安全事项:
亚硫酸钠和盐酸都是化学品,应注意避免皮肤和眼睛接触。
亚硫酸钠和盐酸在混合后会产生热量,应注意避免烫伤。
二氧化硫是一种有毒气体,应注意避免吸入。
氯化钠是一种腐蚀性物质,应注意避免接触。
6.3 急救措施
如果发生意外,应立即采取以下措施:
皮肤或眼睛接触化学品,应立即用大量清水冲洗。
吸入二氧化硫,应立即到室外呼吸新鲜空气。
烫伤,应立即用冷水冲洗伤口。
中毒,应立即送医治疗。
7. 结论
盐酸与亚硫酸钠之间的反应是一种重要的化学反应,产物包括氯化钠盐、水并释放二氧化硫气体。这一反应不仅在实验室制备二氧化硫气体时具有应用,而且在工业上也可以用于其他化学合成过程中。了解和掌握这些化学反应的机理和应用,对于化学工作者和工业生产具有重要意义。
参考:
[1]https://en.wikipedia.org/wiki/Sodium_sulfite
[2]https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/sodium-sulfite
[3]https://www.vedantu.com/question-answer/
[4]https://www.geeksforgeeks.org/
[5]https://byjus.com/
[6]https://www.rolledalloys.com/environments/hydrochloric-acid/
[7]https://www.chegg.com/homework-help/questions-and-answers/

