我们现在可以进一步探讨我们的杂化程序。当只有一个2p轨道和一个2s轨道发生杂化时,我们会得到两个杂化轨道,即sp轨道。这种排列留下了两个未杂化的2p轨道(图6-20)。
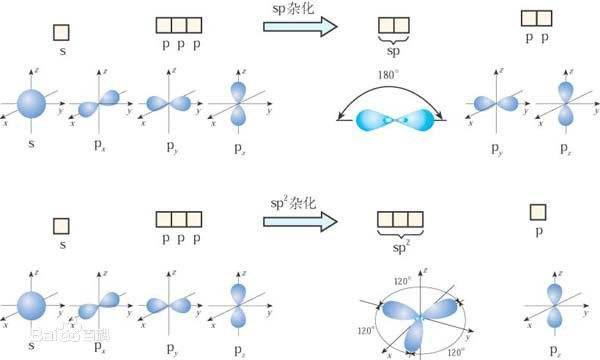
当两个碳原子的两个8p杂化轨道相互作用时,两个sp轨道以头碰头的方式重叠形成一个强的σ键(图6-21)。除此之外,如图6-21所示,两套未杂化的轨道都处于合适的取向,能够肩并肩地重叠,从而形成了两个x键。因此,两个碳原子是通过三个价键相互结合在一起的。这种结合形式被称为参键。请注意,两个氢原子和两个碳原子都在一条直线上,形成一种线性结构。
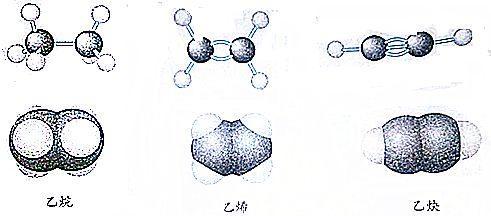
(a)两个sp杂化碳原子与来自两个氢原子的两个8轨道的重叠图。在分子中有两个C-H键,一个C-O键和两个O-C键(使净一个O键成为一个参键)。连接两个结包的虚线表示未杂化p轨道的肩并肩重叠。
( b)乙炔中成键轨道的总轮廓。

