在化学这门领域中,混成(hybridization)主要的概念是将多个原子轨域混合形成新的混成轨域(hybridized orbitals),它能用来定性地描述原子间键结的性质。除此之外,混成轨域在解释分子的分子轨域形状时非常有用,也通常与价层电子对互斥理论(valence shell electron-pair repulsion (VSEPR) theory)共同来解释分子的形状。
二、历史沿革
混成理论是化学家莱纳斯.鲍林(Linus Pauling)于1931年时提出的,当时他是为了要解释甲烷(CH4)的简单分子结构。本来这个概念主要是拿来解释简单的分子结构,不过这个方法被使用地越来越广泛,以至于到今天已经成为一个有效而可以拿来合理化解释各种有机化合物结构的方法。
轨域是一个能表现出电子在分子间行为的模型。就简单的混成而言,它的估测主要是基于原子轨域,类似于氢原子所得到的结果,也是利用已知的薛丁格方程式(Schrodinger equation)精确计算出来的。若是对于重原子来说,像是碳、氮和氧,它们的原子轨域主要是利用2s及2p轨域,类似氢原子的激发态。混成轨域一般是假设为许多原子轨域的组合,以不同的比例叠加而成。混成轨域不一定要拿来描述分子,只不过对于那些利用碳、氮和氧(或少数含有硫、磷)所组成的分子来说,混成理论是可以让分子结构的解释更为简单。
三、混成种类(不含d轨域的参与)
(1) sp3 混成(sp3 hybrids)
对于以正四面体的方式配位的碳原子来说,例如甲烷(methane,分子式CH4),它必须有四个轨域去键结四个氢原子。碳的基态电子组态是1s2 2s2 2px1 2py1:
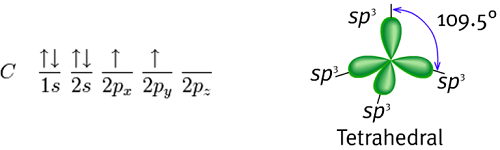
以共价理论去预测,发现有两个半填满的p轨域,故碳可以与氢原子形成两个共价键,即CH2。但是 CH2是活性非常高的分子,不可能单独存在,也因此共价理论无法解释甲烷的存在。除此之外,基态的电子轨域亦无法用于CH4的键结,但是当激发一个2s轨域的电子至2p轨域时,就能够根据共价理论允许四个键结,也暗示着CH4四个键结因为有来自不同轨域的能阶重叠而有不同的能量,不过有实验驳斥了这个说法,也就是从CH4拔掉任何一个碳上的氢其实都是一样容易的,所以也间接说明此四个键的能量其实是相等。
所以我们先以甲烷的例子来看,首先混成的第一步是碳会被激发一个2s轨域的电子至2p轨域,如下图所示:

就碳必须键结四个氢而言,必须要有四个键结轨域。因此,碳的2s 轨域(内层轨域的1s电子几乎不会拿来做键结) 会与三个2p轨域进行混成形成四个sp3混成轨域,即:

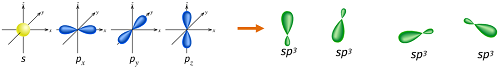
此时,这四个sp3混成轨域即可与氢原子的1s 轨域交叠,得到四个σ(sigma)键,也就是四个单键,且此四个键的长度及强度均相等,分子形状为正四面体(tetrahedral)。

(2) sp2 混成(sp2 hybrids)
其他以碳为主的化合物或分子都能以类似甲烷的方式去解释。又例如乙烯(ethene,分子式C2H4),碳碳之间有一双键。

对于此分子来说,碳会以sp2的方式混成,因为碳碳之间必需有一个形成双键的π(pi)键,而且一个碳只有三个σ键形成。在sp2的混成中2s轨域仅与2p 轨域中的两个轨域进行混成:

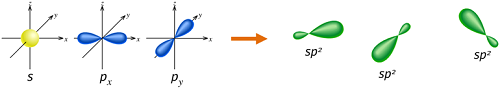
形成共三个sp2轨域而有一个p轨域留着。在乙烯中两个碳原子间藉由两个sp2轨域交叠形成一个σ键且每个碳原子也与氢原子藉由s–sp2的交叠形成两个共价的σ键,键角均为120 °。而碳碳之间的π键是藉由2p–2p的交叠形成,且与分子平面垂直。所有碳-氢键的长度及强度都相等,亦与实验结果相符。
(3) sp 混成(sp hybrids)
化合物中像是炔类这种内含三键的一般都是以sp混成的方式。例如乙炔(ethyne,分子式C2H2),亦可与类似甲烷sp3混成的方式去解释。
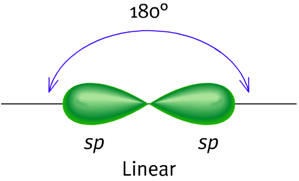
在这个模型中,2s轨域只会与三个p轨域的一个进行混成而形成两个sp轨域,另外两个p轨域则留着。乙炔中的化学键是含有碳-碳之间以sp–sp交叠而形成的σ键以及两个以p–p交叠而形成的π键,还有碳-氢键中以s–sp交叠而形成的σ键,键角180°。
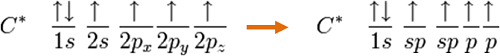

四、混成与分子形状
混成(Hybridization)搭配价层电子对互斥理论(VSEPR Theory)可帮助我们解释分子形状。(A、X表不同原子,E表示孤对电子对)
(1) AX1 (e.g., LiH):无混成,一般都是直线形。
(2) AX2 (e.g., BeCl2):sp 混成,直线形或对角线形,键角∠XAX为180°。
(3) AX2E (e.g., GeF2):sp 混成,角形或V形,键角∠XAX小于 120°(孤对电子对效应)。
(4) AX3 (e.g., BCl3): sp2 混成,平面三角形,键角∠XAX为120°。
(5) AX4 (e.g., CCl4):sp3混成,正四面体形,键角∠XAX约为109.5°。
(6) AX3E (e.g.,NH3):sp3混成,三角锥形,键角∠XAX约为107°(孤对电子对效应)。
(7) AX5 (e.g., PCl5):sp3d混成,双三角锥形。
(8) AX6 (e.g., SF6):sp3d2 混成,正八面体形或双四角锥形。
参考文献
(1) http://en.wikipedia.org/wiki/Hybrid_orbital
(2) http://www.mhhe.com/physsci/chem ... y/flash/hybrv18.swf

