铁(Ⅲ)与大多数阴离子以盐的形式存在,除了那些由于有还原剂特性的阴离子与铁(Ⅲ)不能相容。例如,可以从水溶液中得到粉红色到几乎白色的水合物Fe(ClO4)3·10H2O、Fe(NO3)3·9(或6)H2O和Fe2(SO4)3·10H2O。
水合化学铁离子在水溶液中的一个显著特征是倾向于水解和(或)形成络合物。水解的平衡常数控制了水解的几个步骤:
[Fe(H2O)6]3+=[Fe(H2O)5(OH)]2++H+,K=10(-3.05次方)
[Fe(H2O)5(OH)]2+=[Fe(H2O)4(OH)2]++H+,K=10(-3.26次方)
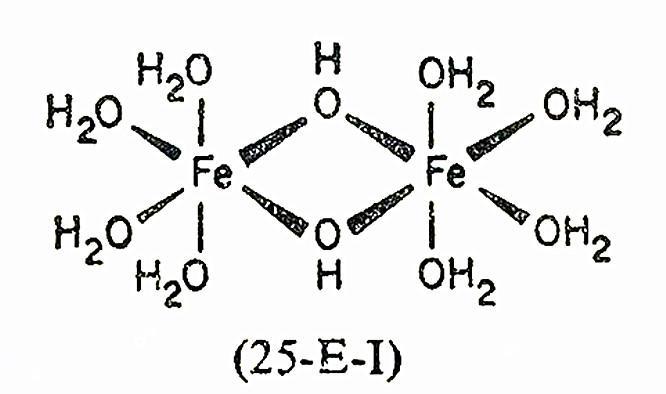
2[Fe(H2O)6]3+=[Fe(H2O)4(OH)2Fe(H2O)4]4+2H+,K=10(-2.91次方)
根据这些平衡常数,即使在较酸性的条件下(pH2~3),水解程度也很大。为了使溶液中主要含有FeⅢ的淡紫色六水合离子(假定约99%),pH必须接近零。当pH提高到2~3以上时,会生成比双核络合物更高级的缩合物,平衡反应变得更慢,不久就会形成凝胶。最后,水合氧化铁以红棕色凝胶物沉淀下来。
双核络合物的离解动力学已经研究过,考虑了各种可能的途径,包括速率定律(包括与酸无关和有关的项)和其他因素。
没有证据表明存在确定的氢氧化物Fe(OH)3,通常被称为红棕色沉淀的氢氧化铁最好被称为水合氧化铁Fe2O3·nH2O的一部分。至少从外观上看,它是上面提到的FeO(OH)沉淀的一部分。
各种羟基物种,如[Fe(OH)(H2O)5]2+是黄色的,由于电荷转移带在紫外区,其尾部进入可见区。因此,铁盐的水溶液,即使是与非络合性阴离子(除强酸以外)结合的溶液也是黄色的。
水合氧化铁(Ⅲ)易溶于酸,稍微溶于强碱。当氢氧化锶或钡的浓溶液与高氯酸铁共沸时,会得到白色结晶粉末的六羟基合铁(Ⅲ)酸盐M3Ⅱ[Fe(OH)6]2。水合氧化铁(Ⅲ)与碱金属氢氧化物一起煮沸可以得到组成为MⅠFeO2的物质,MⅠFeO2也可以用熔融的Fe2O3与碱金属氢氧化物或碳酸盐以适当的化学计量比例作用而制得。可以推测中等浓度的[Fe(OH)6]3-离子能在强碱溶液中维持。
水溶液中的三价铁很容易被许多还原剂还原,例如上面提到的I-。三价铁也能氧化硫离子,因此在FeⅢ溶液中通入H2S或加入硫化物会沉淀出硫化铁,但很快会转变成硫化铁(Ⅱ)和胶体硫的混合物。向铁(Ⅱ)溶液中加入碳酸盐或碳酸氢盐会沉淀出水合氧化物。