请按此连结,参阅「学生讲义三」
教师手册(Teacher’s Guide)
教学提示
● 上课时间:教师实验解说:约15分钟,学生自製微量滴定管:约10分钟,学生自製小型电磁搅拌器:约20分钟,学生实验操作和数据记录:约40分钟。学生 数据处理和回答问题(家庭作业或课堂讨论):约30分钟。若微量滴定管和小型电磁搅拌器由教师组装,可以节省上课时间约30分钟。
● 本实验可配合高二化学氧化还原滴定单元实施。学生自製微量滴定管和自製小型电磁搅拌器可以融入生活科技课程和物理课程的教学中。
● 请教师提醒学生预先以蒸馏水代替优碘溶液,以熟练自製微量滴定管的操作技巧。
● 自製小型电磁搅拌器的转速快慢可透过调整电路中的可变电阻来完成。在滴定时,若无此搅拌器,则可以用咖啡搅拌匙或塑胶筷等当作玻棒,以手动方式搅拌滴定的溶液。
● 由于本次使用滴定的装置并非实验室正规的装置,因此本实验的精确度和準确度较低,但是若仔细地操作,则最后的抗坏血酸的含量可以得到三位有效数字。
● 本实验的待测样品可考虑使用市售的维他命C锭、柳橙或橘子果汁。
优碘碘分子浓度的标定
A.标定步骤
1. 使用在「学生讲义三」的微量滴定步骤,取高纯度的硫代硫酸钠五水化合物,来标定优碘的碘分子之体积莫耳浓度。
2. 使用电子天平秤取0.10~0.20 g(精秤到0.001 g)硫代硫酸钠五水化合物(Na2S2O3·5H2O),置于微量滴定装置下方塑胶容器中,加入20滴的澱粉指示剂,并加入10-20 mL的蒸馏水。
3. 以优碘溶液滴定至开始出现深蓝色且维持30秒即可。记录所需滴定优碘溶液之体积。
4. 重複上述步骤二至三次。
5. 以计算优碘的碘分子浓度。
B.计算碘分子的浓度
以下为一次滴定的计算过程
1. 秤取硫代硫酸钠五结晶水(Na2S2O3·5H2O)的重量:0.100 g
2. 所需滴定优碘溶液的体积:6.18 mL
3. 硫代硫酸钠与碘分子反应为氧化还原反应,如反应式[3]所示:
I2 + 2S2O32- → 2I- + S4O62- [3]
4. 已知Na2S2O3·5H2O的莫耳质量为248.19 g/mol。
由反应式[3]得知:I2莫耳数 × 2 = Na2S2O3莫耳数 × 1
亦即,I2分子的体积莫耳浓度 × (优碘溶液的mL) / (1000 mL/L) × 2
= (一次滴定硫代硫酸钠五结晶水的g) / (Na2S2O3·5H2O的莫耳质量) × 1
5. 经由上述计算便可求得优碘的碘分子浓度:0.0326 M
药品配製
● 澱粉指示剂:取一小汤匙的玉米粉置于250 mL的烧杯中,加150 mL的蒸馏水搅拌,加热至沸腾10钟以上,使之溶解,冷却后取上层澄清液,装在一个塑胶瓶中。
数据记录与处理样本
● 记录维他命C沖饮包的厂牌和型号:五洲生物科技的斯斯维他命沖饮包
● 记录维他命C沖饮包包装盒上,所记载含抗坏血酸的毫克数: 150 (mg/包),
● 配製此维他命C沖饮包的总体积(沖饮液): 100.0 (mL/包)。
● 记录优碘的碘分子浓度:0.0326 M(由老师提供)。
● 记录滴定的实验数据及数据处理于表一。
表一??滴定的实验数据及数据处理
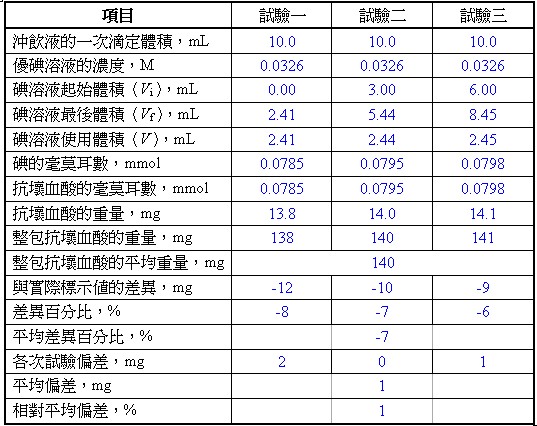 利用在当量点时,氧化剂和还原剂的当量数相等,计算维他命C沖饮包中含抗坏血酸的毫克数。
利用在当量点时,氧化剂和还原剂的当量数相等,计算维他命C沖饮包中含抗坏血酸的毫克数。
(1)计算一次滴定使用沖饮液的体积为整包维他命C沖饮液的体积的倍数。
一次滴定使用体积为整包含量的倍数 = 10.00 mL沖饮液 / 100.0 mL的沖饮液 = 1/10
(2)计算一次滴定使用沖饮液的抗坏血酸含量为整包含量的倍数。
一次滴定使用抗坏血酸含量为整包含量的倍数 = 10.00 mL沖饮液 / 100.0 mL的沖饮液 = 1/10
(3)以试验一为例,计算一次滴定碘的毫莫耳数。
一次滴定碘的毫莫耳数 = 2.41 mL × 0.0326 mmol/mL = 0.0785 mmol
(4)以试验一为例,计算抗坏血酸的毫克数,抗坏血酸的莫耳质量为176.14 g/mol。
一次滴定抗坏血酸的毫克数 = 0.0785 mmol × 176.14 mg/mmol = 13.8 mg
(5)计算每次滴定含抗坏血酸的毫克数之平均值。
每次滴定抗坏血酸的毫克数之平均值 = (13.8 mg + 14.0 mg + 14.1 mg) / 3 = 14.0 mg
(6)计算整包含抗坏血酸的毫克数。
整包含抗坏血酸的毫克数 = 14.0 × 10 = 140. mg
(7)整包含抗坏血酸的实验值与实际标示值的差异及差异百分比。
两者差异 = 140. – 150. = -10. mg
两者差异百分比 = (-10./150) × 100% = -7%
(8)计算本实验的平均偏差及相对平均偏差。
平均值 = (138 mg + 140. mg + 141 mg) / 3 = 140. mg
平均偏差 = (2 mg + 0 mg + 1 mg) / 3 = 1 mg
相对平均偏差比 = (1 mg /140. mg) × 100% = 1%
参考答案
1. 因为考虑微量滴定管只有10 mL的容量,所以滴定体积以不超过10 mL为原则。参考包装盒标示维他命C沖饮包每包含抗坏血酸的毫克数为150 mg。根据理论计算,已知1 mL之优碘溶液约可与维他命C沖饮包中6.9 mg之抗坏血酸作用。若10 mL优碘溶液完全滴定完毕,最多能滴定69 mg的抗坏血酸。现考虑维他命C沖饮液的配製成100 mL的被滴定液,以一次取10.00 mL来进行此氧化还原滴定,理论上取10.0 mL维他命C沖饮液之抗坏血酸含量 = 150 mg × (10/100) = 15 mg,并未超过69 mg。
2. (1)当滴定结束时,再把三通塑胶活栓顺时针旋转90度,必须注意以免造成滴定过量。(2)有关滴定终点的判读,需仔细观察滴定下方塑胶容器内溶液颜色呈线深蓝色且不再褪去。
3. 以数据记录与处理样本为例,装盒标示维他命C沖饮包每包含抗坏血酸的毫克数为150 mg,而实验测得整包维他命C沖饮包中含抗坏血酸的毫克数为140. mg,两者差异为10 mg、两者差异百分比为-7%。
此误差来源有下面几点可能:(1)配製已好维他命C沖饮包被滴定液,在等待及滴定过程中被空气将其氧化,造成误差。(2)由于维他命C沖饮包被滴定液本身有些许颜色(淡黄色),对滴定终点判定,有些许影响,因而造成误差。
参考资料和延伸阅读
1. Baeza, A., “Microbureta a Microescala Total para Totulometría” Rev. Chil. Educ. Cient. 2003, 12, 4-7.
2. Acid-base neutralisation – a microscale titration, http://www.practicalchemistry.or ... tration,171,EX.html.
3. Determination of Vitamin C Concentration by Titration, http://www.outreach.canterbury.a ... vitaminc_iodine.pdf.
4. Determination of Vitamin C, http://wwwchem.csustan.edu/chem1112/1112vitc.htm.
5. Assay of Ascorbic Acid in vitamin C tablets, http://www.pua.edu.eg/PUASite/up ... t_on_Validation.pdf.
6. 化学情境试题:维他命C的定量分析(Quantitative Analysis of Vitamin C)〔I〕,http://highscope.ch.ntu.edu.tw/wordpress/?p=9867。
7. 吴柏青、郭晓怡,应用直接碘滴定法在金针乾製品二氧化硫残留量快速检测,宜兰技术学报,第7期,2001,页17-26。

