连结:简易的滴定终点判定-两点电位法(Two-point Potentiometric Titration)〔I〕
学生讲义之二(Student Handout II)
药品和器材
1. 自製小型电磁搅拌器??1套/组
2. 简易型酸硷度计(如泰菱电子仪器,型号pH-704)??1支/组
3. 标準缓冲溶液(pH 7和pH 4)??1瓶/组
4. 蒸馏水(装在洗瓶内)??1瓶/组
5. 滤纸(或无毛屑面纸1包)??1盒/班
6. NaOH标準溶液(0.1 M已标定)??30~50 mL/组
7. 量筒(瘦长型,容量10.00 mL,精确度0.01 mL)??2个/组
8. 容量瓶(100 mL)??1个/组
9. 塑胶容器(小型)??1个/组
10. 烧杯(100 mL)??2个/组
11. 食用醋??5 mL/组
12. PE滴管??2支/组
实验步骤
A.简易型酸硷度计的校正
本次实验採用泰菱电子仪器型号pH-704的简易型酸硷度计,其校正步骤如下所示。一般而言,酸硷度计的校正步骤:(1)先用pH 7.00标準缓冲溶液,(2)再用pH 4.00或pH 10.00标準缓冲溶液。
1. 开启电源并打开电极保护盖,以蒸馏水清洗电极并用滤纸或面纸吸乾。
2. 置入电极于pH 7.00标準缓冲溶液中,摇晃后让显示值稳定,再用小螺丝起子在酸硷度计的背面调整显示值为7.00,如图八的左图所示。
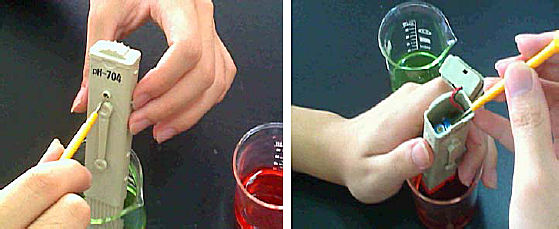
图八 校正酸硷度计的操作
3. 显示值7.00稳定后,即完成此点的校正。取出电极,用蒸馏水清洗电极并用滤纸或面纸吸乾。
4. 然后,置入电极到pH 4.00标準溶液中,摇晃后让显示值稳定,再用小螺丝起子在电池盖内调整显示值为4.00,如图八的右图所示。
5. 显示值7.00稳定后,即完成此点的校正。取出电极,用蒸馏水清洗电极并用滤纸或面纸吸乾。
6. 重複步骤2~5,使酸硷度计的测量斜率稳定。
7. 测量待测液:先用洗瓶内蒸馏水清洗电极,再用滤纸或面纸吸乾,插入电极到待测溶液中,均匀地摇晃,读取酸硷度计的pH值。
B.估计滴定终点前pH的範围
已知乙酸(醋酸)的Ka = 1.8 × 10-5,即pKa = 4.74。利用[式5],估计在滴定终点前pH的範围。
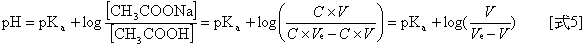 1. 在滴定终点前,当NaOH标準溶液使用体积为0.96倍的当量点体积(即V = 0.96 Ve)时,代入[式5],得pH = 6.12,计算过程如下所示。
1. 在滴定终点前,当NaOH标準溶液使用体积为0.96倍的当量点体积(即V = 0.96 Ve)时,代入[式5],得pH = 6.12,计算过程如下所示。
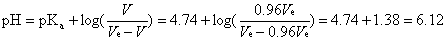 2. 在滴定终点前,当NaOH标準溶液使用体积为0.98倍的当量点体积(V = 0.98 Ve)时,代入[式5],得pH = 6.43,计算过程如下所示。
2. 在滴定终点前,当NaOH标準溶液使用体积为0.98倍的当量点体积(V = 0.98 Ve)时,代入[式5],得pH = 6.43,计算过程如下所示。
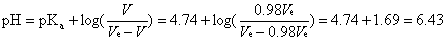 C.食用醋的稀释
C.食用醋的稀释
1. 用一支PE滴管吸取食用醋,置入一支10 mL的量筒中,量取体积5.00 mL的食用醋。
2. 完全转移5.00 mL的食用醋到一支100 mL的容量瓶中,加蒸馏水到100.00 mL的刻度线,此稀释溶液为原来食用醋浓度的1/20倍。每次滴定取20.00 mL的待测液,可用于五次滴定。
D.两点法的滴定
1. 用一支10.00 mL的量筒,以两次量取方式共取20.00 mL的食用醋稀释溶液到一个小型塑胶容器中,插入已校正的酸硷度计于待测溶液中。
2. 接着使用PE滴定管吸取NaOH标準溶液到10.00 mL的量筒中,读取量筒的起始刻度(Vi)并记录之。
3. 开始使用一支PE滴管自上述的量筒中吸取NaOH标準溶液,逐滴地滴入待测溶液中,进行本实验的酸硷滴定,并同时注意酸硷度计的pH读数与变化,如图九所示。

图九 由PE滴定管滴入少量的NaOH标準溶液至待测溶液中
4. 经由上面「B. 估计滴定终点前pH的範围」,可考虑在滴定终点前,当pH值的读数在6.0时,便可以读取量筒的刻度(Vf)并记录第一组滴定数据(V1,pH1)。接着,再滴入少量的NaOH标準溶液,当pH值的读数比第一组滴定pH1值的读数大于0.3 pH值,便可以读取量筒的刻度(Vf)并记录第二组滴定数据(V2,pH2)。记录这些滴定的数据于下面「数据记录与处理」的表一中。
5. 重覆上述步骤1~4两次,共滴定三次,记录滴定的数据于表一中。
6. 利用在当量点时酸和硷的莫耳数相等,计算食用醋中醋酸的浓度(g/mL)。
安全和注意
● 进行实验操作时,应该注意安全,穿实验衣和戴安全眼镜。若不慎接触NaOH溶液,应该用大量水沖洗,必要时报告老师。
● 若对实验有安全疑虑以及对酸硷度计的使用有任何质疑,请立刻询问老师。
废弃物处理
● 各组实验未用的NaOH溶液应该用稀盐酸中和后排放于水槽中。
● 各组实验未用的食用醋稀释溶液可加水稀释后排放于水槽中。
● 滴定后的混合溶液可加水稀释后排放于水槽中。
数据记录与处理
1. 记录NaOH标準溶液的真正浓度和待测食用醋的基本资料。
NaOH标準溶液的真正浓度: M;
待测食用醋的厂牌和行号:?? ;
待测食用醋所标示的浓度: %。
2. 记录两点法的实验数据并数据处理于表一。
表一??两点法的原始数据及当量点的体积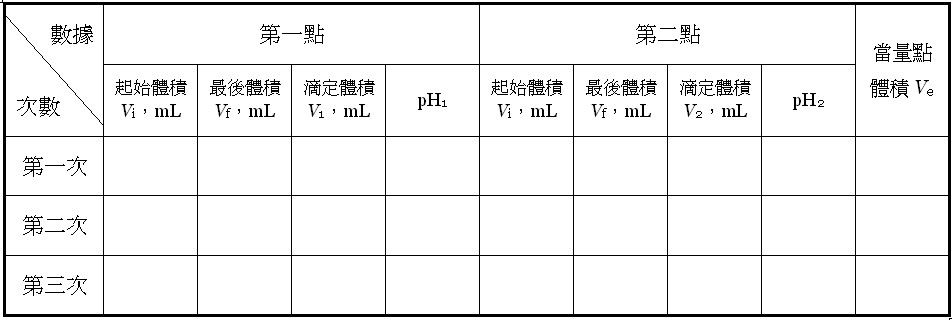 其中NaOH溶液滴定到当量点体积之Ve值是利用[式9]计算而得,△pH = pH2 – pH1。
其中NaOH溶液滴定到当量点体积之Ve值是利用[式9]计算而得,△pH = pH2 – pH1。
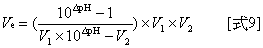 3. 计算三次在当量点时使用NaOH标準溶液体积的平均值 。
3. 计算三次在当量点时使用NaOH标準溶液体积的平均值 。
4. 利用在当量点时酸和硷的莫耳数相等,计算食用醋中醋酸的浓度(g/mL)。
5. 假设食用醋的密度为1.00 g/ml,此食用醋中醋酸的浓度为多少重量百分比?与厂商标示食用醋的浓度符合吗?
问题
1. 食用醋为何要先稀释后才进行酸硷滴定?
2. 若使用未经标定NaOH溶液时,是否可正确计算出食用醋中醋的酸浓度?为什么?
3. 相对于使用酚酞为酸硷指示剂,本次实验採用两点法有何优点?说明其理由。
连结:简易的滴定终点判定-两点电位法(Two-point Potentiometric Titration)〔III〕

