金属键
金属键是由金属元素的电负性较小和电离能较小所导致的。金属原子的外层价电子容易脱离原子核的束缚,在金属晶粒中形成自由电子或离域电子。这些电子和正离子在金属晶粒中自由运动,并通过吸引力形成金属键。金属键没有方向性,每个原子中的电子分布基本上呈球形,使金属原子紧密堆积,形成稳定的体系。金属键的特性决定了金属的导电性、传热性、延展性、光泽和合金形成能力。
金属晶体的结构可以看作是球形原子堆积密度大、配位数高、能充分利用空间的结构。常见的金属结构类型有立方最密堆积、六方最密堆积、双六方最密堆积和体心立方密堆积。
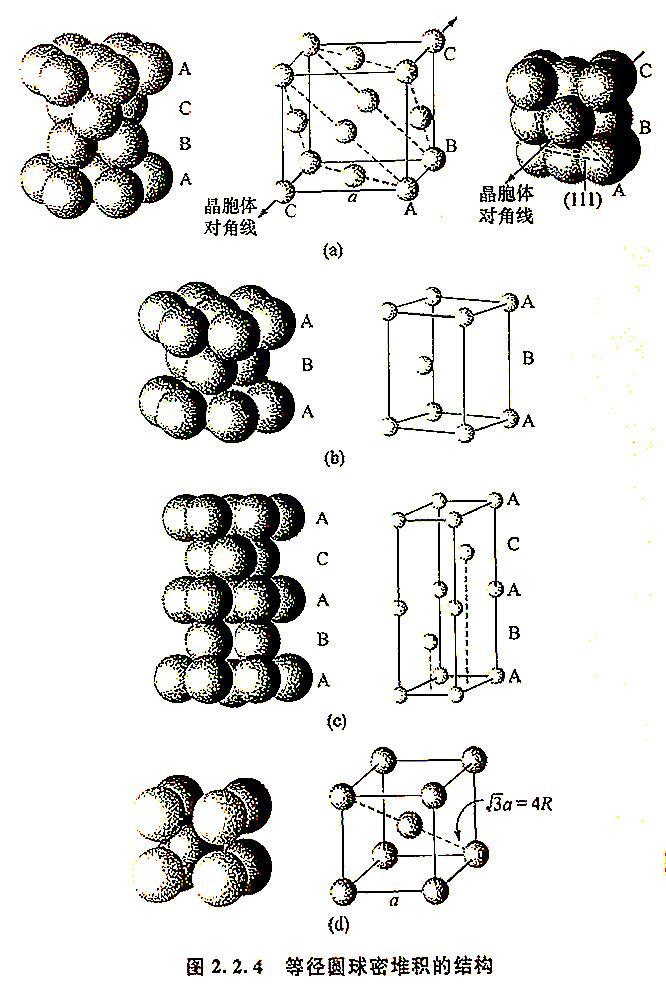
需要注意的是,在某些化合物中,金属原子之间形成金属-金属键,这些键是共价键而不是金属键。
离子键
离子键是由正、负离子之间的静电吸引力形成的化学键,也称为静电键。离子键一般由电负性较小的金属元素和电负性较高的非金属元素形成。离子键的强度与正负离子电价的乘积成正比,与正负离子间的距离成反比。离子化合物通常以晶体状态存在。
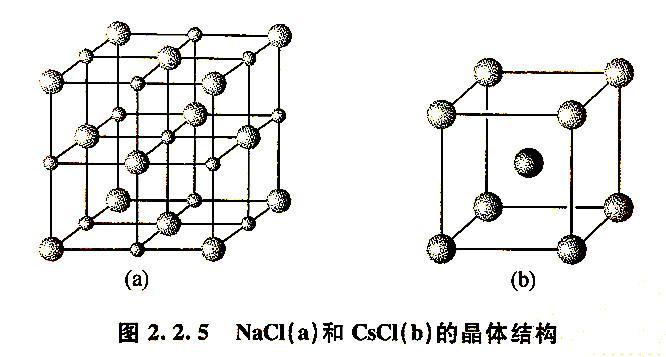
NaCl晶体的结构可以解析其具有的性质:(1)NaCl晶体由Na+和Cl-交替排列,不存在Na-Cl双原子分子。(2)Na+和Cl-之间的接触距离为282pm,提供了离子大小的实验数据。(3)NaCl晶体溶于水时,是正负离子水化的过程,溶液中存在Na+和Cl-离子导电。(4)NaCl晶体的熔点较高,由于每个离子都被异性离子包围吸引,不存在特别薄弱的环节。(5)NaCl晶体中离子位置固定,是绝缘体,但在熔化后,带电的Na+和Cl-能够导电。

