元素化学性质的差异主要是由于三个因素引起的:核电荷的大小和核外売层电子数的多少,它们都等于原子序数;电子层的数目和电子层中的电子数,特别是价电子层的电子数;各电子层之间和电子层与核之间的距离。
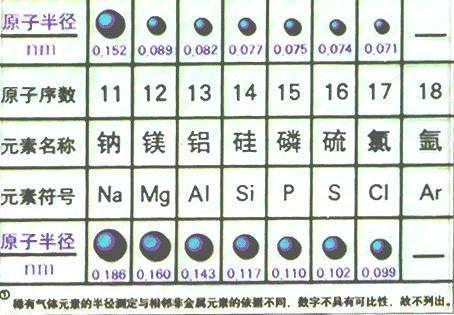
1. 原子半径的变迁一般而言,在周期表中,每个元素的原子半径比它前面一个元素的原子半径小。不过,在各周期末尾的惰性气体都比前面一个原子序数低的元素有较大的原子半径,在单质状态下,惰性气体有完满的最外层结构。
2. 核电荷和核外电子数的变化在周期表中,每个元素(除第一个元素氢之外)的核电荷数比它前面一个元素多一个正电荷。尽管在各周期中电子层数是不变的,每个元素的核外电子数也比它前面一个元素多一个电子。一般而言,在一个给定的周期内,元素的核电荷越大和核外电子数越多,则核电荷对电子的静电吸引也越大。因此,从理论上说,这就造成沿着周期原子半径的变小。
3. 强化学键和范德华力原子半径是以固态物质原子核间距的测量为依据的。强的化学键使固体状态中原子结合得更靠近。不过对惰性气体来说,仅有徽弱的静电引力把原子结合到一起。这个力叫做范德华力,它是一个原子的正电荷对相邻原子电子云的吸引力。这样造成了这些元素有异常大的核间距和原子半径。
4. 周期表的元素变化周期表的各族元素从上而下,下面的元素具有逐渐增大的原子半径,因为电子层数增多了。随着原子大小和原子量的增加,这些元素的金属性依次增强(更容易失去价电子)。尽管在同族中由上向下原子的核电荷是增加了,但由于中间电子层数的增多,被核结合得越来越不牢固。钫是IA族最活泼金属元素和镭是IA族最活泼的金属元素。尽管IA、VA、VIA和ⅢA族开头的元素是非金属元素碳、氮、氧和氟,一般仍可看到在族中从上向下有同样向金属性过渡的趋势。铅(Pb)、铋(Bi)、钋(Po)和砹(At)至少在某种程度上都表现有金属性。
编辑网站:https://www.999gou.cn 999化工商城

